IF 24.9文章:南方醫院方媛研究團隊發現SPHK1調控結直腸癌肝轉移機制_abio生物試劑品牌網
結直腸癌肝轉移(CRLM)是結直腸癌(CRC)最常見的轉移類型,約50%的CRC患者會發生CRLM,多數患者無法手術,5年生存率僅14%。CRLM的特征是具有免疫抑制性微環境,且對免疫治療的反應不佳。值得注意的是,腫瘤相關巨噬細胞(TAMs)在調節免疫反應中發揮關鍵作用,并且在CRLM中表現出顯著的異質性。鞘氨醇激酶1(SPHK1)作為一種關鍵激酶,在維持神經酰胺和鞘氨醇-1-磷酸(S1P)水平的平衡中起重要作用。然而,在CRLM過程中,TAMs中的SPHK1在腫瘤免疫逃逸中所發揮的作用仍不明確。 近期,南方醫科大學南方醫院放療科方媛團隊在Cancer Communications (IF 24.9)發表題為“Targeting SPHK1 in macrophages remodels the tumor microenvironment and enhances anti-PD-1 immunotherapy efficacy in colorectal cancer liver metastasis”的文章。研究結果強調,TAMs中的SPHK1通過促進CD8+T細胞功能異常和形成免疫抑制性微環境,在CRLM的進展中發揮作用,將SPHK1阻斷與抗PD-1療法相結合,可能是CRLM患者一種有前景的治療方案。
 · 維真助力 - AAV、LV及質粒 ·
· 維真助力 - AAV、LV及質粒 ·
基因信息:鞘氨醇激酶1(Sphk1)
病毒產品:AAV-Sphk1
病毒用量:2 μL/mouse(5×10^10 vg/mL)
注射方式:尾靜脈注射
病毒產品:
LV-Sphk1(mouse)
LV-shSPHK1(human)
LV-shSphk1(mouse)
LV-shAdam17(mouse)
病毒滴度:1×10^8 TU/mL
感染細胞:THP-1細胞;MC38細胞
MOI:10 研究方法與結果
1、SPHK1通過調控腫瘤微環境發揮促腫瘤作用
通過對公共RNA-seq和scRNA-seq等數據的分析,研究團隊發現SPHK1在來自CRLM的TAM中高度表達,并且與CRC患者的預后不良密切相關。通過藥物抑制或基因敲除TAMs中的SPHK1,可減少CRLM模型中小鼠肝轉移瘤的數量和直徑,延長其生存期;同時,SPHK1的抑制或敲除會降低肝腫瘤中S1P的水平,表明靶向TAMs中的SPHK1能有效抑制CRLM進展。進一步分析發現TAMs中SPHK1缺失后,CRLM模型小鼠的TME免疫抑制狀態得到逆轉,具體表現為肝轉移腫瘤中TAMs比例減少,CD4+T細胞、CD8+T細胞及常規樹突狀細胞比例增加;CD8+T細胞的耗竭標志物(如PD-1、LAG3)表達降低,效應分子(如IFN-γ)及激活標志物(如CD44、CD25)表達升高。隨后,研究團隊將慢病毒載體轉導THP1細胞,建立SPHK1穩定敲低的細胞系,體外共培養實驗也證實,SPHK1缺失的巨噬細胞可減少CD8+T細胞耗竭并增強其抗腫瘤活性,且該效應依賴于TAMs和CD8+T細胞的存在。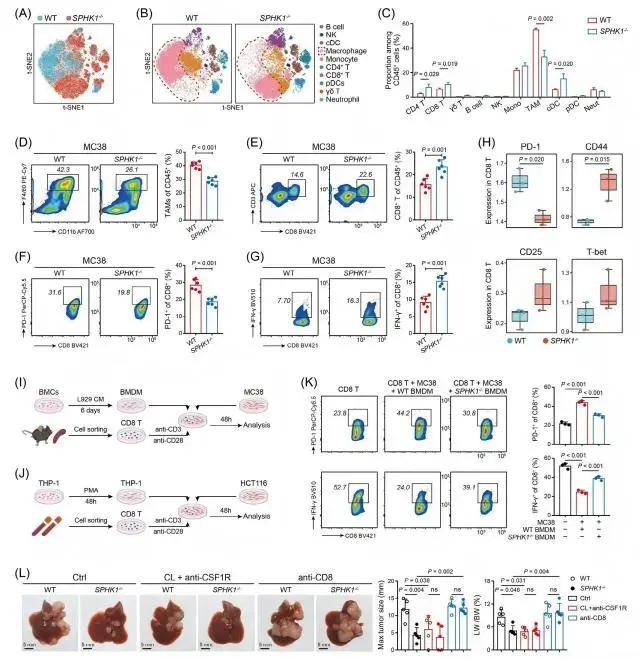 TAMs中SPHK1缺陷逆轉CRLM的免疫抑制性TME 2、SPHK1-S1P軸通過NLRP3炎性體促進TAMs分泌IL-1β
TAMs中SPHK1缺陷逆轉CRLM的免疫抑制性TME 2、SPHK1-S1P軸通過NLRP3炎性體促進TAMs分泌IL-1β
RNA-seq數據分析顯示SPHK1-S1P軸增強IL-1β和NLRP3的mRNA表達。通過GSEA確定了SPHK1-/-TAM和SPHK1敲低CRC中NLRP3炎性體通路的顯著下調。進一步探索發現S1P可上調BMDM和THP-1來源TAMs中NLRP3炎癥小體相關蛋白的表達,而敲低SPHK1則會減少這些蛋白的表達。此外,CRC細胞與活化的CD8+T細胞共培養可通過IFN-γ促進TAMs中SPHK1磷酸化以及IL-1β和NLRP3的表達。提示TAMs中CD8+T細胞驅動SPHK1-NLRP3-IL-1β軸,這一過程可能參與CRLM的適應性免疫逃避。隨后利用AAV-SPHK1將SPHK1導入TAMs,導致小鼠肝轉移灶增加,而IL-1β拮抗劑可逆轉這一效果。這些數據表明TAM中的SPHK1通過IL-1β介導的免疫抑制促進肝轉移進展。進一步的機制探索證實S1P-S1PR2軸通過NF-κB和HIF-1α信號通路激活NLRP3炎性體。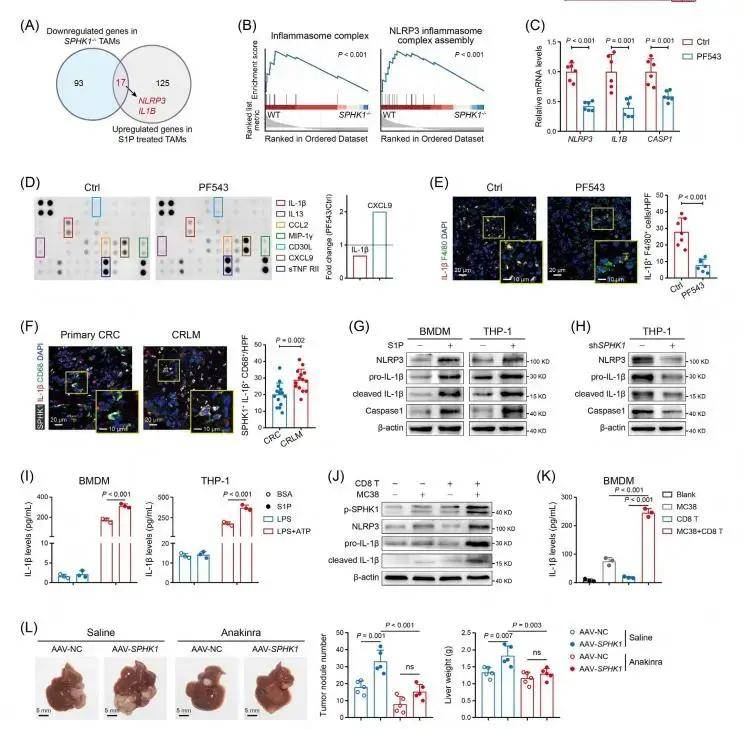 SPHK1-S1P軸通過NLRP3炎性體促進TAMs中IL-1β的分泌 3、rIL-1β處理的CRC細胞促進TAM募集和CD8+T細胞功能障礙
SPHK1-S1P軸通過NLRP3炎性體促進TAMs中IL-1β的分泌 3、rIL-1β處理的CRC細胞促進TAM募集和CD8+T細胞功能障礙
細胞因子陣列顯示,SPHK1敲低的THP-1細胞與HCT116細胞、CD8+T細胞共培養時,上清中CCL2水平顯著降低,而IL-2水平升高;TAMs中CCL2表達不受SPHK1調控或S1P預處理影響,但與SPHK1敲除/敲低巨噬細胞共培養的 CRC細胞中,單核細胞趨化因子(CCL2、CCL7、CCL8、CXCL12)水平顯著降低。重組IL-1β(rIL-1β)可顯著上調CRC細胞中單核細胞趨化因子的表達;Transwell實驗顯示,SPHK1缺陷顯著抑制與CRC細胞共培養時的巨噬細胞遷移,且SPHK1-/-肝腫瘤中CCL2表達較低。這些數據表明,表達SPHK1的TAM促進IL-1β分泌,然后與CRC細胞相互作用,以招募更多的TAM進入TME。蛋白質組學分析發現,rIL-1β處理的MC38細胞分泌組中ADAM17及多種單核細胞趨化因子富集,ELISA證實rIL-1β可誘導ADAM17分泌,且IL-1β與ADAM17 表達呈正相關。進一步的分析表明SPHK1+TAMs通過IL-1β誘導CRC細胞釋放ADAM17,從而限制CD8+T細胞的運輸和抗腫瘤活性。聯合治療效果評估發現,SPHK1靶向治療可增強抗PD-1免疫治療的療效,聯合治療能顯著抑制CRLM,減少肝轉移灶數量,延長小鼠生存期,且與放療聯合時效果更優,同時可降低放療導致的肝損傷。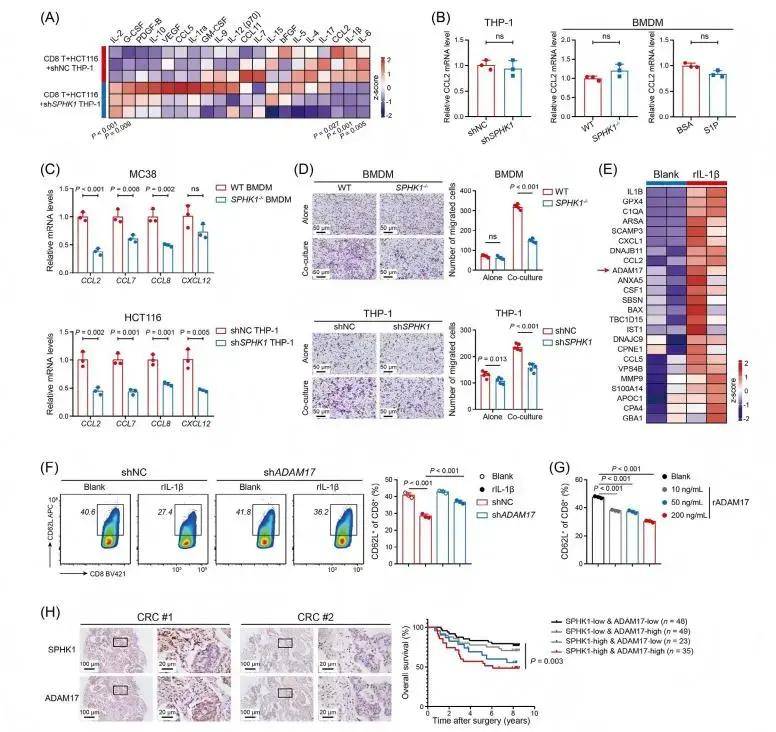 rIL-1β處理的CRC細胞促進TAM募集和CD8+T細胞功能障礙 總結
rIL-1β處理的CRC細胞促進TAM募集和CD8+T細胞功能障礙 總結
本研究揭示SPHK1在TAMs中通過S1P-NLRP3-IL-1β 通路促進CRLM的腫瘤免疫微環境的形成,導致CD8+T細胞功能障礙和免疫治療耐藥。強調聯合靶向SPHK1與抗PD-1治療是CRLM的潛在有效治療策略。 返
 · 維真助力 - AAV、LV及質粒 ·
· 維真助力 - AAV、LV及質粒 ·
基因信息:鞘氨醇激酶1(Sphk1)
病毒產品:AAV-Sphk1
病毒用量:2 μL/mouse(5×10^10 vg/mL)
注射方式:尾靜脈注射
病毒產品:
LV-Sphk1(mouse)
LV-shSPHK1(human)
LV-shSphk1(mouse)
LV-shAdam17(mouse)
病毒滴度:1×10^8 TU/mL
感染細胞:THP-1細胞;MC38細胞
MOI:10 研究方法與結果
1、SPHK1通過調控腫瘤微環境發揮促腫瘤作用
通過對公共RNA-seq和scRNA-seq等數據的分析,研究團隊發現SPHK1在來自CRLM的TAM中高度表達,并且與CRC患者的預后不良密切相關。通過藥物抑制或基因敲除TAMs中的SPHK1,可減少CRLM模型中小鼠肝轉移瘤的數量和直徑,延長其生存期;同時,SPHK1的抑制或敲除會降低肝腫瘤中S1P的水平,表明靶向TAMs中的SPHK1能有效抑制CRLM進展。進一步分析發現TAMs中SPHK1缺失后,CRLM模型小鼠的TME免疫抑制狀態得到逆轉,具體表現為肝轉移腫瘤中TAMs比例減少,CD4+T細胞、CD8+T細胞及常規樹突狀細胞比例增加;CD8+T細胞的耗竭標志物(如PD-1、LAG3)表達降低,效應分子(如IFN-γ)及激活標志物(如CD44、CD25)表達升高。隨后,研究團隊將慢病毒載體轉導THP1細胞,建立SPHK1穩定敲低的細胞系,體外共培養實驗也證實,SPHK1缺失的巨噬細胞可減少CD8+T細胞耗竭并增強其抗腫瘤活性,且該效應依賴于TAMs和CD8+T細胞的存在。
 TAMs中SPHK1缺陷逆轉CRLM的免疫抑制性TME 2、SPHK1-S1P軸通過NLRP3炎性體促進TAMs分泌IL-1β
TAMs中SPHK1缺陷逆轉CRLM的免疫抑制性TME 2、SPHK1-S1P軸通過NLRP3炎性體促進TAMs分泌IL-1β
RNA-seq數據分析顯示SPHK1-S1P軸增強IL-1β和NLRP3的mRNA表達。通過GSEA確定了SPHK1-/-TAM和SPHK1敲低CRC中NLRP3炎性體通路的顯著下調。進一步探索發現S1P可上調BMDM和THP-1來源TAMs中NLRP3炎癥小體相關蛋白的表達,而敲低SPHK1則會減少這些蛋白的表達。此外,CRC細胞與活化的CD8+T細胞共培養可通過IFN-γ促進TAMs中SPHK1磷酸化以及IL-1β和NLRP3的表達。提示TAMs中CD8+T細胞驅動SPHK1-NLRP3-IL-1β軸,這一過程可能參與CRLM的適應性免疫逃避。隨后利用AAV-SPHK1將SPHK1導入TAMs,導致小鼠肝轉移灶增加,而IL-1β拮抗劑可逆轉這一效果。這些數據表明TAM中的SPHK1通過IL-1β介導的免疫抑制促進肝轉移進展。進一步的機制探索證實S1P-S1PR2軸通過NF-κB和HIF-1α信號通路激活NLRP3炎性體。
 SPHK1-S1P軸通過NLRP3炎性體促進TAMs中IL-1β的分泌 3、rIL-1β處理的CRC細胞促進TAM募集和CD8+T細胞功能障礙
SPHK1-S1P軸通過NLRP3炎性體促進TAMs中IL-1β的分泌 3、rIL-1β處理的CRC細胞促進TAM募集和CD8+T細胞功能障礙
細胞因子陣列顯示,SPHK1敲低的THP-1細胞與HCT116細胞、CD8+T細胞共培養時,上清中CCL2水平顯著降低,而IL-2水平升高;TAMs中CCL2表達不受SPHK1調控或S1P預處理影響,但與SPHK1敲除/敲低巨噬細胞共培養的 CRC細胞中,單核細胞趨化因子(CCL2、CCL7、CCL8、CXCL12)水平顯著降低。重組IL-1β(rIL-1β)可顯著上調CRC細胞中單核細胞趨化因子的表達;Transwell實驗顯示,SPHK1缺陷顯著抑制與CRC細胞共培養時的巨噬細胞遷移,且SPHK1-/-肝腫瘤中CCL2表達較低。這些數據表明,表達SPHK1的TAM促進IL-1β分泌,然后與CRC細胞相互作用,以招募更多的TAM進入TME。蛋白質組學分析發現,rIL-1β處理的MC38細胞分泌組中ADAM17及多種單核細胞趨化因子富集,ELISA證實rIL-1β可誘導ADAM17分泌,且IL-1β與ADAM17 表達呈正相關。進一步的分析表明SPHK1+TAMs通過IL-1β誘導CRC細胞釋放ADAM17,從而限制CD8+T細胞的運輸和抗腫瘤活性。聯合治療效果評估發現,SPHK1靶向治療可增強抗PD-1免疫治療的療效,聯合治療能顯著抑制CRLM,減少肝轉移灶數量,延長小鼠生存期,且與放療聯合時效果更優,同時可降低放療導致的肝損傷。
 rIL-1β處理的CRC細胞促進TAM募集和CD8+T細胞功能障礙 總結
rIL-1β處理的CRC細胞促進TAM募集和CD8+T細胞功能障礙 總結
本研究揭示SPHK1在TAMs中通過S1P-NLRP3-IL-1β 通路促進CRLM的腫瘤免疫微環境的形成,導致CD8+T細胞功能障礙和免疫治療耐藥。強調聯合靶向SPHK1與抗PD-1治療是CRLM的潛在有效治療策略。 返
本站“ABIO生物試劑品牌網”圖片文字來自互聯網
如果有侵權請聯系微信: nanhu9181 處理,感謝~


